Cuaderno Digital
Cuaderno Digital Química
Leonardo Peralta
BLOQUE 1
1. Hidróxidos
Los hidróxidos o bases son un grupo de compuestos químicos formados por la unión entre un óxido básico (metal + O2) y H2O (agua). El hidróxido es una combinación que deriva del agua por sustitución de uno de sus átomos de hidrógeno por un metal, está presente en muchas bases.
Los hidróxidos se clasifican en: básicos, anfóteros y ácidos.
Formulación:
Los hidróxidos se formulan escribiendo el metal seguido del grupo dependiente con la base de un ion de radical adecuado con hidróxido; este va entre paréntesis si el subíndice es mayor de uno. Dicho de otro modo, se escribe primero el metal y luego el grupo funcional OH, (ion hidróxido, OH-), denominado grupo hidroxilo, que actúa con número de oxidación -1.2 A este oxidrilo se le coloca de subíndice, si el metal tiene valencia superior a 1, se le pone entre paréntesis : (OH), y se coloca por subíndice, la valencia del metal. Luego se balancea.
Ejemplo: óxido básico + agua → hidròxido
Fe2O3 + H2O → Fe (OH)3
El OH tiene de subíndice la valencia del hierro (Fe). Ya se formó la sal; pero aún falta balancear, porque tiene que haber la misma cantidad de cosas de cada lado. Quedaría así:
Fe2O3 + 3H2O → 2Fe (OH)3
2. Ácidos
Ácido es todo compuesto químico que libera o cede iones de hidrógeno (H+) en solución acuosa.
Un ácido es cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7.
Carácteristicas.
Son conductores de energía eléctrica: es decir, este tipo de energía fluye con facilidad a través de sus iones.
Son solubles en agua: es decir, que se disocian o se disuelven en agua con facilidad.
Un ácido de Brønsted-Lowry es cualquier especie capaz de donar un protón H+
Una base de Brønsted-Lowry es cualquier especie capaz de aceptar un protón, lo que requiere un par solitario de electrones para enlazarse a H+
El agua es una sustancia anfótera, ya que puede actuar como un ácido de Brønsted-Lowry y como una base de Brønsted-Lowry.
La base conjugada de un ácido de Brønsted-Lowry es la especie que se forma después de que un ácido donó un protón. El ácido conjugado de una base de Brønsted-Lowry es la especie que se forma cuando una base acepta un protón.
Las dos especies en un par ácido-base conjugado tienen la misma fórmula molecular, excepto que el ácido tiene un H+ extra en comparación con su base conjugada.
BLOQUE 2
En el ámbito de la química, se denomina sal a aquel compuesto que resulta del reemplazo de los átomos de hidrógeno que forman parte de un ácido por ciertos radicales básicos.
Las sales binarias, también conocidas como sales neutras, son el resultado de la combinación entre un metal y un no metal. De acuerdo a la fórmula de esta combinación de tipo binario, primero se debe escribir el símbolo del metal junto a su valencia y luego el símbolo del no metal con su valencia correspondiente.
HX + M (OH) = MX + H2O
Una sal ox(o)ácida, oxosal u oxisal es el producto de sustituir alguno, o todos, los hidrógenos de un oxácido por cationes metálicos, por ejemplo K+, o no metálicos, por ejemplo NH4+. Cuando se sustituyen todos los hidrógenos se forma una oxisal neutra y cuando solo se sustituye una parte una sal ácida.
Características de las oxisales
La mayoría de las sales son solubles en agua.
La mayoría de los carbonatos metales alcalinos son poco solubles en agua.
Las sales típicas tienen un punto de fusión alto, baja dureza, y baja compresibilidad.
Fundidas o disueltas en agua, conducen la electricidad.
ÁCIDO OXÁCIDO M(XO) + BASE = SAL OXISAL + AGUA
3. SALES ÁCIDAS
Las sales ácidas son una clase de sales que producen una solución ácida después de ser disueltas en un disolvente. Su formación como sustancia tiene una mayor conductividad eléctrica que la del disolvente puro.1
En la molécula de las sales ácidas se presenta la unión de un metal a un radical negativo y un no metal positivo, pero entre ellos se encuentra el hidrógeno. Para nombrarlas se utiliza el nombre del radical para las sales con el prefijo bi y después se anota el nombre del metal.
Cuando reacciona una base con un ácido, ésta pierde todos los grupos (OH) y el ácido pierde todos los hidrógenos (H) formándose una sal neutra, pero cuando el ácido conserva por lo menos 1 de los hidrógenos se obtiene una sal ácida.
ÁCIDO + BASE = SAL ÁCIDA + AGUA
Las sales básicas son todas aquellas que al disolverse en agua generan soluciones con valores de pH mayores que 7. Esto se explica por la formación de iones OH–, los cuales provienen directamente del proceso de disolución o del equilibrio de hidrólisis donde participa el anión.
Las sales básicas contienen el anión OH– en sus sólidos. Por ejemplo, los hidróxidos alcalinos, como el de sodio y potasio, NaOH y KOH, se consideran miembros de estas sales; aunque son en extremo cáusticas, razón por la que merecen la denominación de hidróxidos en lugar de llamarse sales.
HX + M (OH) = M(OH)X + H2O
Las sales dobles son sales que contienen más de un catión o más de un anión. Las sales dobles son compuestos cuaternarios . Se forman cuando al menos dos sales se disuelven en un mismo líquido y cristalizan de forma regular. Una sal doble muy conocida es el alumbre de sodio, que contiene dos cationes (sodio y aluminio) y un anión sulfato. Otros ejemplos notables son el tartrato de potasio y sodio o Sal de Seignette y la alstonita. Las sales dobles se nombra colocando primero el nombre del anión seguido de la palabra “doble” y luego el nombre, en orden alfabético, de los elementos que forman los cationes, precedidos por los prefijos di, tri, tetra etc., de acuerdo al sub índice que presente cada catión en la fórmula molecular. Cuando el sub índice es uno (1) no se coloca el prefijo.
HX + M1 (OH) + M2 (OH) = M1 M2 X + H2O
Sales oxisales mixtas Son compuestos cuaternarios que resultan de la acción de dos radicales ácidos oxácidos diferentes sobre un mismo metal. Se los nombre primero los radicales y luego el metal.
Son compuestos cuaternarios que resultan de la acción de dos radicales y ácidos oxácidos diferentes sobre un mismo metal se lo nombra primero por los radicales y luego el metal.
El nombre del los hidrácidos terminados en uro tomando en cuenta el hidróxido de menor número de oxidación seguido del nombre del metal. Las reglas para nombrar las sales mixtas en el sistema tradicional son análogas a las sales ácidas.
HX1 + HX2 + M(OH) = MX1X2 + H2O
BLOQUE 3
Redox es el nombre que recibe una reacción de tipo químico que implica la transferencia de electrones entre distintos reactivos, lo que lleva a una modificación del estado de oxidación. En estas reacciones, un elemento pierde electrones y el otro, los recibe.
El término redox refiere a la Reducción-Oxidación que se da en el marco de la reacción. Hay un elemento que acepta los electrones que libera el otro y que se reduce al producirse una minimización de su estado de oxidación. El elemento que se encarga de la liberación de los electrones, por su parte, se oxida. Mientras que el elemento que gana electrones se conoce como agente oxidante, el elemento que los libera recibe el nombre de agente reductor, es una combinación entre un proceso de reducción (un elemento capta electrones y reduce su estado de oxidación) y un proceso de oxidación (un elemento libera electrones y aumenta su estado de oxidación). Estos dos procesos son, en realidad, dos facetas simultáneas de la reducción, que siempre se llevan a cabo en conjunto. Cada vez que hay un elemento que se oxida al liberar electrones, existe otro que los acepta y se reduce.
Formado por solvente y soluto
Clasificados en Ópticos y Tamaño
%.m-m= msoluto/msolución x 100
%. v-v= vsoluto/vsolución x 100
%.m-v= msoluto/vsolución x 100
En las suspensiones, la fase dispersa es sólida, mientras que la fase dispersante puede ser líquida o gaseosa. En este tipo de dispersiones la separación de fases se opera con mayor dificultad que en las groseras. Sistemas coloidales: en estas dispersiones el medio disperso solo es visible con el ultramicroscopio.
3. Concentración de soluciones
La concentración de una disolución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolución o, a veces, de disolvente; donde el soluto es la sustancia que se disuelve, el solvente es la sustancia que disuelve al soluto, y la disolución es el resultado de la mezcla homogénea de las dos anteriores. Por menor proporción de soluto disuelto en el solvente, menos concentrada está la solución, y a mayor proporción más concentrada está.
Una disolución (solución) es una mezcla homogénea, a nivel molecular, de dos o más sustancias.1
El término también es usado para hacer referencia a un proceso de concentración, y aumentar la proporción de soluto en el solvente, inverso al de dilución.)
4. Masas moleculares
Es una magnitud que indica cuántas veces la masa de una molécula de una sustancia es mayor que la unidad de masa atómica. Su valor numérico coincide con el de la masa molar, pero habitualmente expresado en unidades de masa atómica (su unidad en el SI es el kilogramo), en lugar de gramos/mol. La masa molecular alude a una sola molécula, mientras que la masa molar corresponde a un mol (NA = 6,022 · 1023) de moléculas.
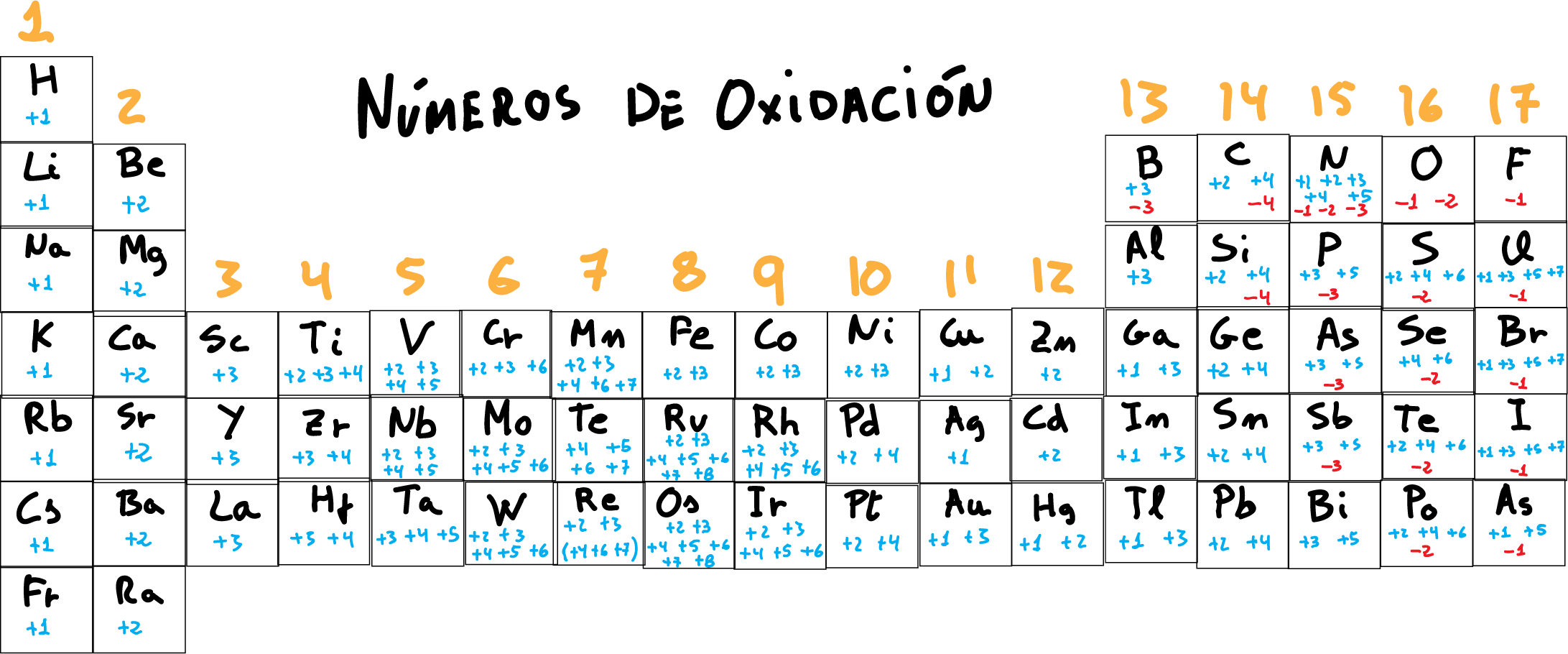
El estado de oxidación (EO) es un indicador del grado de oxidación de un átomo que forma parte de un compuesto u otra especie química (por ejemplo un ion). Formalmente, es la carga eléctrica hipotética que el átomo tendría si todos sus enlaces con elementos distintos fueran 100 % iónicos. El EO es representado por números, los cuales pueden ser positivos, negativos o cero. En algunos casos, el estado de oxidación promedio de un elemento es una fracción, tal como +8/3 para el hierro en la magnetita (Fe3O4). El mayor EO conocido es +8 para los tetraóxidos de rutenio, xenón, osmio, iridio, hassio y algunos compuestos complejos de plutonio, mientras que el menor EO conocido es -4 para algunos elementos del grupo del carbono (elementos del grupo 14).
La estequiometría es el cálculo para una ecuación química balanceada que determinará las proporciones entre reactivos y productos en una reacción química.
El balance en la ecuación química obedece a los principios de conservación y los modelos atómicos de Dalton como, por ejemplo, la Ley de conservación de masa que estipula que:
la masa de los reactivos = la masa de los productos
En este sentido, la ecuación debe tener igual peso en ambos lados de la ecuación.
Estequiometria masa-masa
La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa
de los elementos químicos que están implicados (en una reacción
química). También estudia la proporción de los distintos elementos en
un compuesto químico y la composición de mezclas químicas.
Estequiometría mol-mol
Las relaciones estequiométricas determinan la cantidad de sustancias que participan en una reacción química, siendo el mol la unidad de medida a utilizar para la cuantificación de reactivos y productos.
Estequiometría mol-masa
La cantidad conocida de una sustancia y la cantidad de sustancia de interés se expresan en términos de masa. En esta relación estequiométrica, la cantidad conocida de una sustancia se expresa en moles y la cantidad requerida se expresa en términos de masa o volumen.
8. Número de Avogadro
La constante de Avogadro o "número de Avogadro" (símbolos: L, NA) es el número de partículas constituyentes (usualmente átomos o moléculas) que se encuentran en la cantidad de sustancia de un mol. Por tanto, es el factor proporcional que relaciona la masa molar de una sustancia a la masa de una muestra. Su valor es igual a 6.02E23
50 gr de NaCl a iones de Na+
Calcular el número de moles que hay en 50 gramos de NaCl.
Sabemos que un Mol de NaCl pesa 23 + 35,5 = 58,5g.
Aplicamos la fórmula nº de moles = masa (g) / M (masa molecular g/mol)
Cada molécula de NaCl contiene un átomo de Na, por tanto, por ejemplo, si tenemos 1000 átomos de NaCl es porque tenemos 1000 átomos de Na y 1000 átomos de Cl juntos, si eliminamos los átomos de Cl para que se nos quede Na+ el número de iones de Na+ será el mismo que el número de moléculas de NaCl, por tanto vamos calcular ese número aplicando el número de Avogadro.
Nº de iones de Na+ = 0,855 x Nº de Avogadro = 0,855 x 6,022x10E23 = 5,15x10E23 iones.
BLOQUE 4
1. Leyes de los gases

La ley experimental de los gases es una ley que combina la ley de Boyle-Mariotte, la ley de Charles y la ley de Gay-Lussac. Estas leyes se refieren a cada una de las variables que son presión, volumen y temperatura absoluta. La ley de Charles establece que el volumen y la temperatura absoluta son directamente proporcionales cuando la presión es constante. La ley de Boyle afirma que presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la presión y la temperatura absoluta, siempre y cuando se encuentre a un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados.
2. Ley de Graham
La ley de Graham se refiere a la velocidad de difusión entre dos gases, la cual está relacionada de manera inversamente proporcional con el peso molecular de cada gas. En la imagen, se muestra el proceso de intercambio de gases que se da en la respiración. Para poder respirar, al interior de los pulmones, se realizan distintos procesos que permiten trasladar el oxígeno y el dióxido de carbono. La velocidad de difusión de estos gases se puede calcular mediante el uso de la ley de Graham.

La velocidad de reacción se define como la cantidad de sustancia que se transforma en una determinada reacción por unidad de volumen y tiempo. Por ejemplo, la oxidación del hierro bajo condiciones atmosféricas es una reacción lenta que puede tardar muchos años, pero la combustión del butano en un fuego es una reacción que sucede en fracciones de segundos.
La cinética química es la parte de la fisicoquímica que estudia las velocidades de reacción, todos los factores asociados a ella y la dinámica química estudia los orígenes de las diferentes velocidades de las reacciones de cinética química.








Cuaderno incompleto, faltan ejercicios de formulación y nomenclatura de todas las sales. Falta el método Redox de balanceo y ejercicios. Faltan varios ejercicios de estequiometría. Incluso tiene el concepto de la PRIMERA LEY DE NEWTON (Física).
ResponderBorrar